Fenomenele și procesele naturale din jurul nostru sunt destul de complexe. Pentru descrierea lor fizică exactă, ar trebui folosit un aparat matematic greoi și ar trebui să se țină seama de un număr mare de factori semnificativi. Pentru a evita această problemă, în fizică sunt folosite unele modele simplificate, care facilitează foarte mult analiza matematică a procesului, dar practic nu afectează acuratețea descrierii acestuia. Unul dintre ele este modelul de gaz ideal. Să o luăm în considerare mai detaliat în articol.
Conceptul de gaz ideal
Un gaz ideal este o stare de agregare a unei substanțe, care constă din puncte materiale care nu interacționează între ele. Să explicăm această definiție mai detaliat.
În primul rând, vorbim despre punctele materiale ca obiecte care alcătuiesc un gaz ideal. Aceasta înseamnă că moleculele și atomii săi nu au o dimensiune, ci au o anumită masă. Este îndrăznețse poate face o aproximare ținând cont de faptul că în toate gazele reale la presiuni scăzute și la temperaturi ridicate distanța dintre molecule este mult mai mare decât dimensiunile lor liniare.
În al doilea rând, moleculele dintr-un gaz ideal nu ar trebui să interacționeze între ele. În realitate, astfel de interacțiuni există întotdeauna. Deci, chiar și atomii de gaze nobile experimentează atracția dipol-dipol. Cu alte cuvinte, interacțiunile van der Waals sunt prezente. Cu toate acestea, în comparație cu energia cinetică de rotație și mișcarea de translație a moleculelor, aceste interacțiuni sunt atât de mici încât nu afectează proprietățile gazelor. Prin urmare, ele nu pot fi luate în considerare atunci când se rezolvă probleme practice.
Este important de reținut că nu toate gazele în care densitatea este scăzută și temperatura este ridicată pot fi considerate ideale. Pe lângă interacțiunile van der Waals, există și alte tipuri de legături mai puternice, de exemplu, legături de hidrogen între moleculele H2O, care duc la o încălcare gravă a condițiilor de idealitate a gazului. Din acest motiv, vaporii de apă nu sunt un gaz ideal, ci aerul este.
Modelul fizic al unui gaz ideal
Acest model poate fi reprezentat astfel: să presupunem că sistemul de gaz conține N particule. Acestea pot fi atomi și molecule ale diferitelor substanțe chimice și elemente. Numărul de particule N este mare, așa că unitatea „mol” este de obicei folosită pentru a o descrie (1 mol corespunde numărului lui Avogadro). Toate se mișcă într-un anumit volum V. Mișcări ale particulelorsunt haotice și independente unele de altele. Fiecare dintre ele are o anumită viteză v și se mișcă pe o cale dreaptă.
Teoretic, probabilitatea de coliziune între particule este aproape zero, deoarece dimensiunea lor este mică în comparație cu distanțele dintre particule. Cu toate acestea, dacă apare o astfel de coliziune, atunci aceasta este absolut elastică. În acest din urmă caz, impulsul total al particulelor și energia lor cinetică sunt conservate.
Modelul considerat al gazelor ideale este un sistem clasic cu un număr mare de elemente. Prin urmare, viteza și energia particulelor din el respectă distribuția statistică a lui Maxwell-Boltzmann. Unele particule au viteze mici, în timp ce altele au viteze mari. În acest caz, există o anumită limită de viteză îngustă, în care se află cele mai probabile valori ale acestei cantități. Distribuția vitezei moleculelor de azot este prezentată schematic mai jos.
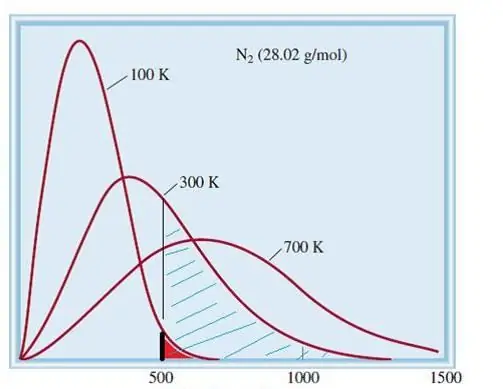
Teoria cinetică a gazelor
Modelul gazelor ideale descris mai sus determină în mod unic proprietățile gazelor. Acest model a fost propus pentru prima dată de Daniel Bernoulli în 1738.

Ulterior, a fost dezvoltat până la starea actuală de către August Kroenig, Rudolf Clausius, Mihail Lomonosov, James Maxwell, Ludwig Boltzmann, Marian Smoluchowski și alți oameni de știință.
Teoria cinetică a substanțelor fluide, pe baza căreia se construiește modelul de gaz ideal, explică două proprietăți macroscopice importante ale sistemului pe baza comportamentului său microscopic:
- Presiunea din gaze este rezultatul ciocnirii particulelor cu pereții vasului.
- Temperatura din sistem este rezultatul manifestării mișcării constante a moleculelor și atomilor.
Să extindem ambele concluzii ale teoriei cinetice.
Presiunea gazului
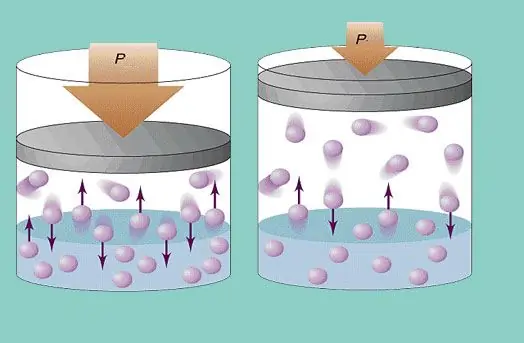
Modelul de gaz ideal presupune o mișcare haotică constantă a particulelor în sistem și o coliziune constantă a acestora cu pereții vasului. Fiecare astfel de ciocnire este considerată absolut elastică. Masa particulelor este mică (≈10-27-10-25 kg). Prin urmare, nu poate crea multă presiune într-o coliziune. Cu toate acestea, numărul de particule și, prin urmare, numărul de ciocniri, este uriaș (≈1023). În plus, viteza pătrată medie a elementelor este de câteva sute de metri pe secundă la temperatura camerei. Toate acestea conduc la crearea unei presiuni apreciabile pe pereții vasului. Poate fi calculat folosind următoarea formulă:
P=Nmvcp2 / (3V), unde vcp este viteza pătratică medie, m este masa particulelor.
Temperatura absolută
Conform modelului de gaz ideal, temperatura este determinată în mod unic de energia cinetică medie a unei molecule sau a unui atom din sistemul studiat. Puteți scrie următoarea expresie care leagă energia cinetică și temperatura absolută pentru un gaz ideal:
mvcp2 / 2=3 / 2kB T.
Aici kB este constanta Boltzmann. Din această egalitate obținem:
T=m vcp2 / (3kB).
Ecuația de stare universală
Dacă combinăm expresiile de mai sus pentru presiunea absolută P și temperatura absolută T, putem scrie următoarea egalitate:
PV=nRT.
Aici n este cantitatea de substanță în moli, R este constanta gazului introdusă de D. I. Mendeleev. Această expresie este cea mai importantă ecuație din teoria gazelor ideale, deoarece combină trei parametri termodinamici (V, P, T) și nu depinde de caracteristicile chimice ale sistemului de gaze.

Ecuația universală a fost derivată pentru prima dată experimental de către fizicianul francez Emile Clapeyron în secolul al XIX-lea și apoi adusă la forma sa modernă de chimistul rus Mendeleev, motiv pentru care poartă în prezent numele acestor oameni de știință.






